消化管粘膜下腫瘍(SMT)は、粘膜筋板、粘膜下層、または固有筋層から発生する隆起性病変であり、管腔外病変である場合もあります。医療技術の発展に伴い、従来の外科的治療選択肢は徐々に、lなどの低侵襲治療の時代へと移行してきました。腹腔鏡手術とロボット手術。しかし、臨床現場では「手術」がすべての患者に適しているわけではないことが分かっています。近年、内視鏡治療の価値が徐々に注目を集めています。SMTの内視鏡診断と治療に関する中国の専門家コンセンサスの最新版が発表されました。この記事では、関連する知識を簡単に紹介します。
1.SMTの流行の特徴論理学
(1)SMの発生率T は消化管のさまざまな部分で不均一であり、胃が SMT の最も一般的な部位です。
様々な発生率消化管の部位は不均一で、上部消化管に発生することが多い。そのうち2/3は胃に発生し、次いで食道、十二指腸、結腸に発生する。
(2)組織病理学的SMT の種類は複雑ですが、ほとんどの SMT は良性病変であり、悪性病変はごくわずかです。
A.SMTには含まれません異所性膵臓組織や腫瘍性病変などの非腫瘍性病変。
B.腫瘍性病変の中で胃腸平滑筋腫、脂肪腫、ブルセラ腺腫、顆粒膜細胞腫瘍、シュワン細胞腫、およびグロムス腫瘍はほとんどが良性であり、15%未満が組織悪性腫瘍として現れることがあります。
C.消化管間質SMT における腫瘍 (GIST) と神経内分泌腫瘍 (NET) は、ある程度の悪性度を秘めた腫瘍ですが、その大きさ、位置、種類によって異なります。
D.SMTの位置は関連している病理学的分類によると、a. 平滑筋腫は食道SMTの一般的な病理学的型であり、食道SMTの60%から80%を占め、食道の中部および下部に発生する可能性が高い。b. 胃SMTの病理学的型は比較的複雑で、GIST、平滑筋腫、および胃粘膜下層癌が報告されている。胃粘膜下層癌(SMT)のうち、胃粘膜下層癌(GIST)は胃底部および胃体部に最も多く見られ、平滑筋腫は通常噴門部および胃体上部に発生し、異所性膵臓および異所性膵臓が最も多く見られます。脂肪腫は胃前庭部に多く見られます。c. 脂肪腫と嚢胞は十二指腸の下行部および球状部に多く見られます。d. 下部消化管SMTのうち、脂肪腫は結腸に多く見られ、NETは直腸に多く見られます。
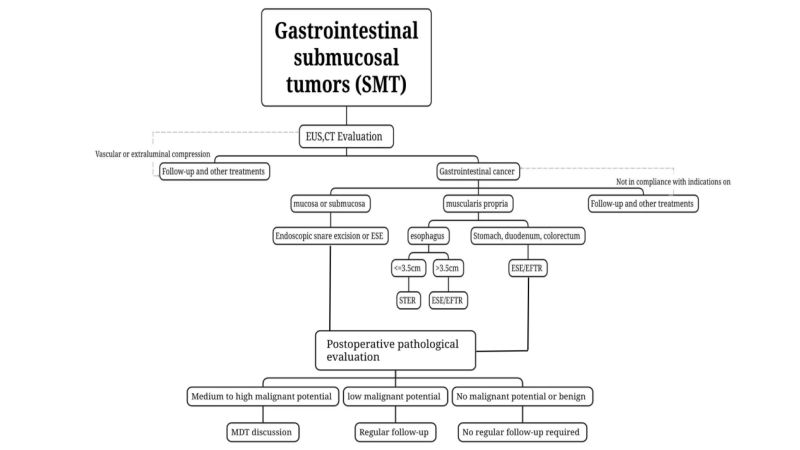
(3)CTとMRIを用いて腫瘍のグレード分け、治療、評価を行う。悪性腫瘍の疑いがある、または腫瘍が大きい(長い)SMTについては、直径2cmを超える場合は、CTとMRIの検査が推奨されます。
CTやMRIなどの他の画像診断法もSMTの診断において非常に重要である。腫瘍の発生部位、増殖様式、病変の大きさ、形状、分葉の有無、密度、均一性、造影効果の程度、境界輪郭などを直接表示することができ、腫瘍の肥厚の有無や程度を判定することができる。消化管壁の硬化。さらに重要なのは、これらの画像検査によって、病変の隣接組織への浸潤の有無、周囲の腹膜、リンパ節、その他の臓器への転移の有無を検出できることです。これらは、腫瘍の臨床グレード分類、治療、予後評価における主要な方法です。
(4)組織サンプル採取は推奨されない脂肪腫、嚢胞、異所性膵臓など、従来の内視鏡検査とEUSを組み合わせて診断できる良性SMTに推奨されます。
悪性病変が疑われる場合、または従来の内視鏡検査とEUSを組み合わせても良悪性の病変を評価できない場合は、EUSガイド下細針吸引生検を使用することができます(内視鏡的超音波ガイド下細針吸引生検)。内視鏡下手術では、穿刺吸引生検(EUS-FNA/FNB)、粘膜切開生検(MIAB)、などの方法で生検を行い、術前病理学的評価を行っています。EUS-FNAの限界と内視鏡的切除への影響を考慮し、内視鏡手術の適応となる症例では、腫瘍の完全切除を確実に行えることを前提に、内視鏡治療技術が成熟したユニットでは、経験豊富な内視鏡医が術前病理診断を得ずに直接内視鏡切除術を行っています。
手術前に病理標本を採取する方法は侵襲的であり、粘膜を損傷したり粘膜下組織に癒着を引き起こしたりして、手術の難易度が上がり、出血や穿孔のリスクが増加する可能性があります。腫瘍の転移および播種は、術前生検が必ずしも必要ではありません。特に、脂肪腫、嚢胞、異所性膵臓など、従来の内視鏡検査とEUSの併用で診断できるSMTの場合は、組織採取は必要ありません。
2.SMT内視鏡治療nt
(1)治療の原則
リンパ節転移がないか、リンパ節転移のリスクが非常に低く、内視鏡的手法で完全切除が可能で、残存腫瘍および再発のリスクが低い病変は、治療が必要な場合、内視鏡的切除が適しています。腫瘍を完全に切除することで、残存腫瘍および再発のリスクを最小限に抑えることができます。内視鏡的切除術では腫瘍のない治療の原則に従い、切除中に腫瘍被膜の完全性を確保する必要があります。
(2)適応症
i.術前検査で悪性度が疑われる、または生検病理で悪性度が確認された腫瘍、特に消化管腫瘍が疑われるものST では、術前の腫瘍長が 2cm 以下で、再発や転移のリスクが低く、完全切除の可能性があると評価された場合、内視鏡的切除が可能です。長径が 2cm を超える低リスクの GIST が疑われる場合、術前の評価でリンパ節転移や遠隔転移が除外されていれば、腫瘍が完全に切除できることを前提に、成熟した内視鏡治療技術を備えたユニットで、経験豊富な内視鏡医によって内視鏡手術を行うことができます。
ii. 症状のある(例:出血、閉塞)SMT。
iii. 術前検査で腫瘍が良性であると疑われ、または病理学的に確認されているが、定期的に経過観察ができない、または経過観察期間中に短期間で腫瘍が増大し、強い希望がある患者内視鏡治療用。
(3)禁忌
i. 私に影響を及ぼす病変を特定するリンパ節または遠隔部位に転移します。
ii. リンパ節が透明なSMTの場合nodeまたは遠隔転移がある場合、病理検査を得るためにバルク生検が必要となり、これは相対的禁忌とみなされる。
iii. 詳細な術前検査後評価の結果、全身状態が悪く内視鏡手術が不可能と判断されました。
脂肪腫や異所性膵臓などの良性病変は、通常、痛み、出血、閉塞などの症状を引き起こしません。MT がびらん、潰瘍として現れたり、短期間で急激に増大したりすると、悪性病変である可能性が高まります。
(4)切除方法の選択d
内視鏡的スネア切除術:術前のEUSおよびCT検査で比較的浅く、腔内に突出していることがわかり、スネアで一度に完全に切除できるSMTの場合は、内視鏡的スネア切除術を使用できます。
国内外の研究では、2cm未満の浅部SMTでは安全かつ有効であり、出血リスクは4%から13%、穿孔リスクは1%であることが確認されている。リスクは2%から70%です。
内視鏡的粘膜下層剝離術(ESE):長径が2cm以上のSMT、またはEUSやCTなどの術前画像検査で粘膜下層剝離が確認された場合腫瘍が腔内に突出している場合、重要な SMT の内視鏡的スリーブ切除には ESE が実行可能です。
ESEは、内視鏡的粘膜下層剥離術(ESD)と内視鏡的粘膜切除術(EMR)を併用し、腫瘍周囲に円形の「フリップトップ」切開を施してSMTを覆う粘膜を除去し、腫瘍を完全に露出させることを日常的に行っています。これにより、腫瘍の完全性を維持し、手術の根治性を高め、術中合併症を軽減するという目的を達成しています。腫瘍径が1.5cm以下の場合、完全切除率は100%です。
粘膜下トンネル内視鏡切除術イオン、STER:トンネルを形成しやすい食道の筋層、門、胃体小弯、胃幽門、直腸から発生したSMTで、横径が3.5cm以下の場合は、STERが最適な治療法となる。
STERは経口内視鏡的食道括約筋切開術(POEM)に基づいて開発された新しい技術であり、ESD技術の拡張である。学問。SMT治療におけるSTERの一括切除率は84.9%~97.59%に達します。
内視鏡的全層切除術イオン、EFTR:トンネル形成が困難な場合や、腫瘍の最大横径が3.5cm以上でSTERが適応とならない場合にSMTに用いることができます。腫瘍が紫膜下層に突出している場合や、空洞の一部を超えて増殖している場合、手術中に腫瘍が漿膜層に強固に付着して剥離できない場合にも用いることができます。EFTRは内視鏡的治療を行います。
穿孔部の適切な縫合EFTR後の腫瘍摘出部位の安全性は、EFTRの成功の鍵となります。腫瘍の再発リスクを正確に評価し、腫瘍の転移リスクを低減するために、EFTR中に切除した腫瘍標本を切開して除去することは推奨されません。腫瘍を断片的に切除する必要がある場合は、腫瘍の播種および転移リスクを低減するために、まず穿孔を修復する必要があります。縫合方法には、金属クリップ縫合、吸引クリップ縫合、大網パッチ縫合法、ナイロンロープと金属クリップを組み合わせた「巾着袋縫合」法、レーキ金属クリップ閉鎖システム(スコープ上クリップ、OTSC)、オーバーステッチ縫合などの新しい技術があり、消化管損傷の修復や出血への対処などに活用されています。
(5)術後合併症
術中出血: 患者のヘモグロビンが 20 g/L 以上低下する出血。
術中の大量出血を防ぐため、手術中は、十分な粘膜下注射を行い、太い血管を露出させ、電気凝固による止血を容易にする必要があります。術中の出血は、各種切開ナイフ、止血鉗子、金属クリップ、および剥離過程で発見された露出血管の予防的止血によって治療できます。
術後出血:術後出血は、吐血、下血、または血便として現れます。重症の場合は出血性ショックを起こす可能性があります。通常は術後1週間以内に発生しますが、2~4週間後に発生することもあります。
術後出血は多くの場合、術後の血圧コントロール不良や胃酸による残存血管の腐食といった要因が挙げられます。また、術後出血は病変部位にも関連しており、胃前庭部や下部直腸でより多く発生します。
遅発性穿孔:通常は腹部膨満、腹痛の悪化、腹膜炎の兆候、発熱として現れ、画像検査ではガス蓄積または以前と比較してガス蓄積が増加していることが示されます。
創傷縫合不良、過度の電気凝固、早起きして動き回れない、早食い、血糖コントロール不良、胃酸による創傷の侵食などの要因が主に関係しています。a. 創傷が大きい、深い、または創傷が裂けている場合a. 術後、明らかな変化がない場合は、安静・絶食時間を適宜延長し、消化管減圧術を行う(下部消化管手術後の患者は肛門管ドレナージを行う); b. 糖尿病患者は血糖値を厳格にコントロールする;小さな穿孔や軽度の胸腹部感染症の患者は絶食、抗感染、制酸などの治療を行う; c. 胸水がある場合は、閉鎖式胸腔ドレナージや腹腔穿刺を行う。スムーズなドレナージを維持するためにチューブを挿入する; d. 保存的治療後も感染が局在化できない場合や重度の胸腹部感染症を合併している場合は、できるだけ早く外科的腹腔鏡手術を行い、穿孔修復や腹腔ドレナージを行う。
ガス関連の合併症:皮下を含む肺気腫、縦隔気腫、気胸および気腹症。
術中皮下気腫(顔面、頸部、胸壁、陰嚢の気腫として示される)および縦隔気腫(喉頭蓋の腫れ(胃カメラ検査で発見される)は通常特別な治療を必要とせず、肺気腫は自然に解消するのが一般的です。
重度の気胸が発生する手術中[手術中に気道内圧が20 mmHgを超える
(1mmHg=0.133kPa)、SpO2<90%、緊急ベッドサイド胸部X線で確認]、手術は多くの場合、胸部減圧後に継続できます。稲毛。
手術中に明らかな気腹症を呈する患者には、気腹針を用いてマクファーランド点を穿刺する。右下腹部に穿刺針を刺して空気を抜き、手術終了まで穿刺針を刺したままにし、明らかなガスの排出がないことを確認した後に抜きます。
消化管瘻:内視鏡手術によって生じた消化液が漏れ口から胸腔または腹腔内に流れ込みます。
食道縦隔瘻と食道胸郭瘻はよく見られます。瘻が発生した場合は、胸腔ドレナージを実施して瘻孔の状態を維持してください。スムーズな排液と適切な栄養補給を提供します。必要に応じて、金属クリップや様々な閉鎖器具を使用したり、被覆全体をリサイクルしたりすることができます。ステントなどの方法で閉塞を行います。瘻孔。重症の場合は迅速な外科的介入が必要です。
3.術後管理(fフォローアップ
(1)良性病変:病理学脂肪腫や平滑筋腫などの良性病変には、定期的なフォローアップは必須ではないことが示唆されています。
(2)悪性のないSMTアリの可能性:例えば、直腸NETが2cmの場合や、中リスクおよび高リスクのGISTの場合、完全なステージ分類を実施し、追加の治療(手術、化学放射線療法、標的療法)を強く検討する必要があります。治療計画の策定は、多職種による協議と個別的なアプローチに基づいて行う必要があります。
(3)低悪性度SMT:たとえば、低リスクの GIST は、治療後 6 ~ 12 か月ごとに EUS または画像検査で評価し、その後臨床指示に従って治療する必要があります。
(4)中悪性度および高悪性度のSMT:術後病理でタイプ3の胃NET、長さ2cmを超える大腸NET、および中リスクおよび高リスクのGISTが確認された場合は、完全な病期分類を実施し、追加治療(手術、化学放射線療法、標的療法)を強く検討する必要があります。治療計画の策定は、[about us 0118.docx]多分野にわたるコンサルティングと個別の対応。
投稿日時: 2024年1月18日


